Si bien los lentes de contacto son usados en forma segura por millones de personas cada día, éstos presentan un riesgo de infección para los ojos.
Los síntomas de infecciones relacionadas con el uso de lentes de contacto pueden incluir visión borrosa, enrojecimiento inusual de los ojos, dolor en el ojo, lagrimeo o secreción del ojo, mayor sensibilidad a la luz o la sensación de tener un objeto extraño en el ojo. Es importante recordar que algunas de las infecciones relacionadas con el uso de lentes de contacto pueden causar pérdidas serias de la visión e inclusive ceguera, por lo que es importante que vea a su Doctor de los Ojos tan pronto como sea posible para comenzar un tratamiento.
Los factores que contribuyen a una infección por uso de lentes de contacto incluyen:
Uso de lentes para uso prolongado;
Dormir con lentes de contacto;
Intercambio reducido de lágrimas bajo el lente;
Factores ambientales;
Falta de higiene, incluyendo el mantenimiento deficiente de estuches para lentes de contacto o la reutilización o exceso de solución.
Un buen manejo, almacenamiento y limpieza de sus lentes son claves para reducir el riesgo de queratitis.
El Cuidado Apropiado de los Lentes de Contacto . EPIDEMIOLOGÍA DE LAS COMPLICACIONES POR USO DE LENTES DE CONTACTO
Las complicaciones relacionadas con el uso de LC se producen debido a una amplia gama de causas y es evidente que la epidemiología de complicaciones con patogenias distintas será también diferente. Se han realizado con anterioridad intentos para clasificar las complicaciones asociadas con las LC sobre la base de su patogenia (1,2). Debido a la diversidad de las clasificaciones utilizadas por los distintos autores, es difícil hacer una estimación exacta de la frecuencia global de dichas complicaciones. Para la presente revisión, hemos dividido éstas en seis categorías diferenciadas: 1) infecciones corneales, 2) inflamaciones corneales, 3) trastornos tóxicos y por hipersensibilidad, 4) reacciones metabólicas, 5) complicaciones de naturaleza mecánica y 6) complicaciones relacionadas con molestias y sequedad.
2.1 Infecciones corneales
Las infecciones corneales son una complicación poco frecuente, pero importante, del uso de LC. En los casos graves cursa con pérdida de visión debido a la formación de cicatrices (Figura 1) y la perforación. Los casos menos graves también se asocian con una morbilidad significativa, por ejemplo en términos de ingresos hospitalarios, costes del tratamiento, visitas ambulatorias, bajas laborales, imposibilidad de utilizar las LC, dolor intenso y pérdida transitoria de visión.
Aparte de los casos graves, las infecciones de menor importancia se asocian con una morbilidad significativa en término de ingresos hospitalarios, costes de tratamiento, visitas médicas, bajas laborales, etc.
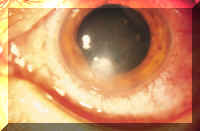
En los portadores de LC, las queratitis microbianas son por lo general bacterianas, aunque también se dan casos debidos a amebas, en particular Acanthamoeba, y con menos frecuencia, a hongos. No se conoce bien la relación entre virus y queratitis asociadas al uso de LC.
2.1.1 Queratitis bacteriana
Antes de que se difundiera el uso de las LC, las queratitis microbianas eran consecuencia sobre todo con traumatismos, antecedentes de trastornos de la superficie ocular o uso de LC terapéuticas o para la corrección de la afaquia. Durante las décadas de 1970 y 1980 fue aumentando el número de informes sobre casos de infecciones relacionadas con el uso de LC (3-8). En 1991, un estudio de casos y controles confirmó que el uso de LC era el factor de riesgo predominante en los casos nuevos de queratitis microbiana y que el 65% de éstos podían atribuirse al uso de LC para corregir pequeños defectos de refracción (9).
Los estudios de casos y controles no permiten estimar la incidencia de la enfermedad. Además, dicha incidencia es baja, por lo que es difícil determinarla utilizando un diseño de estudio de cohortes tradicional. Para conocer la cifra real se necesitaría un número de sujetos demasiado alto.
Un método para conocer la incidencia de la queratitis consiste en hacer encuestas entre oftalmólogos o en centros de atención ocular primaria en una zona seleccionada para conocer el número de casos nuevos de queratitis microbiana registrados a lo largo de un período. Una estimación de la población total de usuarios de LC en esa zona se utiliza como denominador. Esta cifra puede derivarse de entrevistas o de encuestas telefónicas en distritos postales, registros de los médicos generales, censos electorales o datos de ventas de los fabricantes, o bien de datos de los profesionales que adaptan LC en esa área. Cada método conlleva distintas fuentes de sesgo.
En estudios realizados en EEUU (10), Suecia (11,12) y Países Bajos (13) se estimó una incidencia de queratitis infecciosa de 4’1, 3’3 y 2’2 por 10.000 portadores de LC, respectivamente, entre usuarios de LC blandas de uso diario (BUD) y de 20’0, 13’3 y 22’9 por 10.000 portadores, respectivamente, entre usuarios de LC blandas de uso prolongado (BUP). Un análisis de los datos agrupados de estudios de cohortes previos a la comercialización y realizados para la Food and Drug Administration estadounidense mostró cifras muy similares, de 5’2 por 10.000 para las BUD y de 18’2 por 10.000 para las BUP (14). Los resultados de la encuesta realizada por miembros de la Sección de Lentes de Contacto de la American Optometric Association arrojaron cifras de incidencia más elevadas, de 47 por 10.000 para las BUD y de 300 por 10.000 para las BUP (15). Estas últimas cifras se derivaban de estimaciones retrospectivas realizadas por los profesionales participantes en el estudio. Las diferencias entre estudios probablemente tienen su origen en el método empleado, en la selección de casos y controles y en los criterios de diagnóstico. Debido a la falta de precisión absoluta de las pruebas microbiológicas, por lo general, los criterios de diagnóstico de la queratitis microbiana se basan en datos clínicos, en lugar de hacerlo en la positividad de cultivos corneales. En la bibliografía se mantiene el debate sobre si el término «queratitis infecciosa» comprende o no tanto las presuntas lesiones infectadas como las posibles lesiones estériles; sin embargo, en los estudios comentados más arriba sólo se registran las probables lesiones microbianas. Basándose en los resultados de amplios estudios de cohortes, se estima que cada año, aproximadamente uno de cada 2.500 portadores de LC blandas de uso diario y uno de cada 500 portadores de LC blandas de uso prolongado padecerán una "presunta" queratitis microbiana.
A partir de estos datos de incidencia resulta evidente que el riesgo de queratitis difiere según los distintos tipos de lentes y calendarios de uso. También se han realizado estudios de casos y controles para establecer el riesgo relativo de queratitis microbiana para distintos tipos de lentes y estimar el impacto que tienen sobre el mismo factores de riesgo potenciales como el cumplimiento de las recomendaciones de higiene y la antigüedad de la lente. Utilizando como referencia el uso diario de LC blandas, al que se atribuye un riesgo relativo de 1, las estimaciones de riesgo relativo fueron de 0’50x (intervalo de confianza del 95%: 0’15-1’65) para las lentes de PMMA (10) o de 1’3x (14) para las lentes de uso diario permeables a los gases, de 4’6x (14) para las lentes de uso prolongado permeables a los gases, y entre 3’5x (14) y 10’2x (intervalo de confianza del 95%: 5’3-19’6) (16) para las lentes blandas de uso prolongado. Tomando el uso de lentes rígidas permeables como referencia, con un riesgo relativo de 1, las estimaciones del riesgo relativo fueron de 3’6x (intervalo de confianza del 95%: 0’9-13’9) para las lentes blandas de uso diario y de 20’8x (intervalo de confianza del 95%: 7’3-59’6) para las lentes blandas de uso prolongado (9). La tabla 1 resume los factores de riesgo identificados en series de casos y en estudios de casos y controles.

Los estudios sobre la contaminación microbiana de los materiales para el cuidado de las LC de los usuarios con queratitis microbiana demostraron que, con frecuencia, tanto los recipientes como los productos de mantenimiento estaban contaminados (3,17-19). En un pequeño grupo de sujetos se comprobó que los contaminantes de los recipientes eran idénticos desde el punto de vista bioquímico al organismo causal (20). En muchos de estos estudios no se analizaron también los recipientes de portadores asintomáticos, en los que se ha comprobado que es frecuente la contaminación microbiana (19,21-24). Más recientemente se ha confirmado que no hay relación entre la contaminación del estuche de la lente y la mala higiene en pacientes con queratitis microbiana (19,25) y en usuarios asintomáticos (19,26). Sin embargo, antes de estos estudios, el hallazgo de contaminación en los recipientes llevó a pensar que el mal cumplimiento de las normas de mantenimiento desempeñaba un papel clave en la patogenia de la queratitis microbiana.
En contra de ciertos estudios previos, no parece que exista relación entre la contaminación del estuche y la mala higiene en pacientes con queratitis infecciosa.
A finales de la década de 1980 se desarrollaron y presentaron las LC desechables como un avance que iba a reducir las complicaciones del porte de lentes y que podría disminuir también el riesgo de infecciones en los usuarios de lentes blandas. En realidad, aunque la inobservancia de las normas de mantenimiento es un factor de riesgo de queratitis microbiana en los portadores de LC blandas de uso diario, no se ha demostrado que module el riesgo de queratitis microbiana en los portadores de lentes blandas de uso prolongado (Tabla 1). De hecho, los estudios iniciales de casos y controles mostraron un claro aumento del riesgo de queratitis microbiana en los usuarios de LC desechables (27,28). Sin embargo, ninguno de estos dos estudios pudo demostrar que existiera una diferencia significativa en cuanto al riesgo entre las lentes desechables y las tradicionales cuando se utilizaban según el mismo horario. Un nuevo análisis del último de estos estudios (29) identificó un ligero aumento del riesgo de queratitis microbiana de 3’2x (intervalo de confianza del 95%: 1’2-14’4) con el uso de lentes desechables en comparación con el uso tradicional, tras controlar el grado de uso de las lentes en régimen prolongado. Sin embargo, los autores formularon la hipótesis de que este aumento de riesgo se debía a un error de clasificación con respecto al uso prolongado de las lentes entre los sujetos. Un estudio realizado en el Reino Unido mostró un aumento significativo del riesgo con el uso diario de lentes desechables (cociente de probabilidades: 3’5x, intervalo de confianza del 95%: 1’6-7’7) y el uso prolongado de lentes desechables (cociente de probabilidades: 4’8x, intervalo de confianza del 95%: 1’5-14’9) en comparación con el uso tradicional. Los riesgos se ajustaron en función del grado de porte prolongado, de variables demográficas, del uso de la lente y de variables de la higiene (30). Otros estudios de base poblacional mostraron que existía un menor riesgo con el uso de LC desechables en Suecia (11,12) o que no había diferencias en cuanto a la frecuencia de queratitis microbiana entre las lentes desechables y las lentes de uso diario tradicionales (31,32). Es preciso señalar que estos últimos estudios carecían de potencia estadística suficiente para detectar riesgos relativos de 3’5x y se había diseñado para evaluar diferencias entre modalidades de uso en cuanto a las complicaciones más frecuentes. Lo que no se ha abordado en estos estudios es el impacto que tiene sobre el riesgo el uso del mismo tipo de lente en régimen de sustitución programada o desechable. Pese a estas notables controversias, la actual modalidad de porte de lentes desechables no parece haber propiciado el anunciado descenso de la frecuencia de queratitis microbiana en EEUU o Europa. Las lentes desechables de uso diario se han comercializado en muchos países del mundo y se espera que ello reduzca la incidencia de queratitis microbiana al eliminar la necesidad de desinfectar las lentes diariamente y mantener la higiene de los recipientes.
Las lentes desechables no parecen haber modificado la incidencia de queratitis microbiana. Queda por conocer el impacto que puedan tener las lentes de recambio diario.
Se han publicado resultados alentadores en poblaciones pequeñas cuidadosamente seleccionadas y controladas (33,34) o bien seguidas durante cortos períodos (35). Sin embargo, se han publicado informes de casos de queratitis infecciosa en usuarios de lentes desechables de uso diario (36). Cabe pensar que las lentes desechables de uso diario no carecen de complicaciones como la queratitis microbiana, aunque es de prever que los riesgos sean menores. Se necesitarán estudios adecuados de casos y controles y amplios estudios de cohortes para evaluar el riesgo atribuible a esta modalidad de uso.
2.1.2 Queratitis por Acantamoeba
El número de casos de queratitis por Acantamoeba ha aumentado de forma espectacular en los últimos 15 años. Entre los factores predisponentes se cuentan los traumatismos corneales asociados con vegetales, el contacto con insectos o cuerpos extraños transportados por el viento o la exposición al agua caliente de una bañera (37,38). El factor de riesgo más importante es, con mucho, el uso de LC, al cual se asocian el 85% de los casos registrados en los Centers for Disease Control (39).
Sigue sin conocerse la incidencia real de la queratitis por Acanthamoeba entre usuarios de LC, aunque informes aislados la han estimado entre 1:10.000 y 1:250.000 portadores por año. Dado que la queratitis por Acanthamoeba es sumamente infrecuente, se necesitan cohortes de un tamaño imposible de manejar para lograr la potencia estadística que permita estimar con precisión la incidencia. En los estudios iniciales de casos y controles (39,40) se identificaron factores de riesgo potenciales en portadores de LC. Comprenden el empleo de solución salina de elaboración casera, el uso poco asiduo de un sistema de desinfección, el sexo masculino, el porte de LC híbridas (lentes permeables a los gases con una banda periférica de hidrogel) y el hecho de nadar con las lentes. Un estudio más reciente de casos y controles que incluía lentes desechables demostró que no desinfectar las lentes blandas y utilizar sistemas de limpieza basados en el cloro eran los factores que más influían en el aumento de la queratitis porAcanthamoeba (30). Ambos factores de riesgo eran más frecuentes entre los usuarios de lentes desechables, aunque no existía un mayor riesgo asociado con las lentes desechables en sí.
2.2 Infiltrados corneales estériles
Se ha demostrado (41) y avalado con datos epidemiológicos (42) la utilidad de los criterios clínicos para distinguir entre infiltrados infecciosos y presuntamente estériles. El primero en señalar una mayor frecuencia de observaciones de infiltrados corneales estériles asociados con el porte de LC de hidrogel fue Josephson en 1979 (43). A medida que las lentes blandas fueron difundiéndose, los infiltrados fueron haciéndose más frecuentes y aumentó el interés por conocer su incidencia, sus factores de riesgo y su patogenia. Dado que los infiltrados estériles pueden ser asintomáticos (43), es posible que los pacientes no consulten con su médico. En un servicio de urgencias, al que sólo acuden los pacientes con episodios sintomáticos agudos, los infiltrados estériles representan sólo el 8’4% de los portadores de LC que acuden al mismo (44). Josephson informó que, a lo largo de un período de dos años, el 4% de los portadores de LC que acudían a su consultorio tenían infiltrados estériles (43). El cuadro clínico puede variar muchísimo, desde un pequeño infiltrado focal, único, periférico y asintomático, hasta una reacción inflamatoria sintomática y mucho más grave, que comprenda infiltrados focales diseminados e infiltrados difusos. Dependiendo de que se incluyan o no los infiltrados sintomáticos o los asintomáticos, las estimaciones sobre la frecuencia de los infiltrados variará. La incidencia de infiltrados estériles sintomáticos está comprendida entre 12 por 10.000 (31,32) y 160 por 10.000 (45) anuales. En algunos estudios se ha citado una cifra de incidencia de infiltrados estériles (sintomáticos y asintomáticos) del 10% en portadores de lentes desechables de hidrogel (46) en Australia y del 41’6% en India (47).
Debido a que los infiltrados estériles pueden ser asintomáticos, su verdadera incidencia no está bien determinada pero se estima que es superior al 10% de usuarios/año.
Se han calculado los riesgos relativos correspondientes a los distintos tipos de lentes y modalidades de uso en cuanto a los infiltrados focales periféricos de naturaleza estéril (2,42,44,48). Aunque se ha demostrado que existe un mayor riesgo de infiltrados estériles con las LC blandas de uso diario y uso prolongado, la magnitud del mayor riesgo y los factores de riesgo asociados difieren de los asociados con la queratitis microbiana. En comparación con las lentes rígidas permeables a los gases, el uso diario de lentes blandas supone un aumento del riesgo de 2’3x (intervalo de confianza del 95%: 1’3-4’3) (42) y el uso prolongado supone un aumento del riesgo comprendido entre 2’2x (intervalo de confianza del 95%: 0’3-11’4) (27) y 4’6x (intervalo de confianza del 95%: 2’2-9’9) (42). En la tabla 2 se muestra un resumen de los factores de riesgo asociados con infiltrados estériles.

La de los llamados «infiltrados estériles» es una amplia categoría que abarca todos los infiltrados corneales presuntamente no asociados con microorganismos que están replicándose en la córnea. A partir de este espectro de infiltrados, se identificaron y describieron trastornos específicos como el "ojo rojo agudo por lente de contacto" (48) y la úlcera periférica por lente de contacto (49). A continuación se comenta la epidemiología de estas complicaciones en concreto.
2.2.1 Ojo rojo agudo por lente de contacto
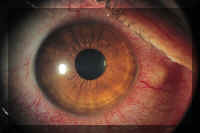
El "ojo rojo agudo por lente de contacto" o "síndrome de la lente apretada" es una reacción inflamatoria que se caracteriza por una hiperemia conjuntival y límbica acentuada, infiltración corneal y dolor (Figura 2). Por definición, se produce sólo durante el uso prolongado y generalmente se inicia por la mañana temprano (49). En un estudio sobre lentes utilizadas de forma continuada, se observó este síndrome en el 34% de los pacientes a lo largo de 12 meses (49). En estudios sobre lentes desechables de uso prolongado se ha registrado una incidencia del síndrome del 12% (47). Otros factores de riesgo son las LC de alto contenido en agua (49), las lentes muy cerradas (49) y un episodio reciente de infección de las vías respiratorias altas (50). En fecha más reciente, se ha descrito la asociación entre la contaminación microbiana de las LC que no se retiran por la noche, en particular por bacterias gram-negativas, y el ojo rojo agudo. Cuando quedaron expuestos a LC contaminadas de forma accidental, un tercio de los pacientes tuvieron una reacción inflamatoria aguda tras una sola noche de uso de las lentes (51). Por añadidura, se ha cultivadoHaemophilus influenzae a partir de la conjuntiva y las LC de portadores diagnosticados de este cuadro (50).
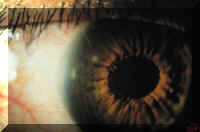
2.2.2 Úlcera periférica por lente de contacto
Una úlcera periférica por lente de contacto (UPLC) es una reacción inflamatoria aguda que se caracteriza por lesiones pequeñas y circulares que afectan a todo el espesor del epitelio de la periferia corneal y se asocian con infiltración estromal (Figura 3) (49). La distinción con respecto a las úlceras infecciosas se basa en criterios clínicos (49). Los estudios histopatológicos de las biopsias tomadas de estas lesiones no muestran invasión del estroma por microorganismos (53). Al igual que en el síndrome de la lente apretada, la UPLC se asocia fundamentalmente con las lentes de uso prolongado y su incidencia está comprendida entre el 2% (50) y el 13% (47) anual. Se ha demostrado la asociación entre la contaminación microbiana de las LC y la UPLC (54) y, más concretamente, la colonización de las LC o de los párpados y la conjuntiva por Staphylococcus aureus (54).
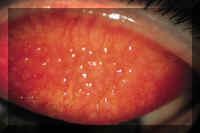
2.3 Reacciones tóxicas y de hipersensibilidad
2.3.1 Reacciones de hipersensibilidad
Las LC son biomateriales que interaccionan con el ojo durante su uso. Las proteínas de la lágrima, las bacterias, los cosméticos y los antígenos ambientales o exógenos pueden adsorberse o absorberse hacia la superficie o la matriz de la lente de contacto. Este material puede acumularse, desnaturalizarse con el tiempo y luego interaccionar con la superficie ocular. Además, las soluciones para el cuidado de las LC contienen agentes antimicrobianos, conservantes, surfactantes y quelantes que pueden ligarse a la lente de contacto o penetrar en ella y liberarse durante el porte. Los antígenos oculares, con su potencial para provocar reacciones de hipersensibilidad, pueden por tanto consistir en componentes de las LC, soluciones de mantenimiento, proteínas del huésped, proteínas bacterianas o material exógeno.
Una de las reacciones de hipersensibilidad mejor caracterizadas de entre las relacionadas con las LC es la asociada con el bacteriostático mercurial thimerosal. La aplicación reiterada produce una reacción local de hipersensibilidad retardada mediada por linfocitos T (55).
2.3.2 Reacciones tóxicas
La queratopatía tóxica se ha atribuido a muchos componentes de las soluciones de mantenimiento de las lentes o de preparaciones de uso tópico, como el digluconato de clorhexidina (56,57), el alquil trietanol de cloruro amónico (58), el cloruro de benzalconio y el ácido sórbico (59). Otras causas son una neutralización insuficiente del peróxido de hidrógeno (58), la presencia de restos de enzimas proteolíticas (60) o la transferencia de surfactante al ojo.
En dos estudios se ha informado sobre los riesgos relativos de reacciones tóxicas/de hipersensibilidad en portadores de LC (1,2)). En ambos se concluyó que las LC blandas entrañaban mayor riesgo de reacciones tóxicas/de hipersensibilidad que las lentes rígidas y que, a diferencia de las reacciones infiltrativas, los usuarios de lentes blandas de uso diario corrían mayor riesgo que los que utilizaban lentes de uso prolongado. En comparación con las lentes rígidas de polimetil metacrilato, Franks informó de un riesgo relativo de 1’3x (intervalo de confianza del 95%: 0’4-4’2) para el uso de lentes permeables a los gases, de 4’5x (intervalo de confianza del 95%: 2’1-9’8) para las LC blandas de uso diario y de 3’3x (intervalo de confianza del 95%: 2’3-9’0) para las lentes blandas de uso prolongado (1). Utilizando lentes permeables a los gases como referencia, el riesgo relativo de reacciones tóxicas/de hipersensibilidad era 5’9x (intervalo de confianza del 95%: 3’3-10’5) mayor en los portadores de lentes blandas de uso diario y 4’5x (intervalo de confianza del 95%: 2’3-9’0) mayor en los usuarios de lentes blandas de uso prolongado (2). El riesgo atribuible en la población estima el porcentaje de casos que pueden atribuirse a cada tipo de lente utilizado en la población objeto de estudio. Las estimaciones del riesgo atribuible en la población mostraron que el 67% de las reacciones tóxicas/de hipersensibilidad podían atribuirse al uso diario y que sólo el 10% podían serlo al uso prolongado de lentes blandas (2). En un estudio más reciente, que incluyó el uso de lentes desechables, no pudo demostrarse ningún efecto protector significativo de las lentes desechables frente a las reacciones tóxicas y de hipersensibilidad. Sin embargo, en el caso concreto de la queratopatía tóxica, el riesgo relativo asociado al uso de lentes desechables era significativamente menor, de 0’4x, que el correspondiente al uso de lentes blandas tradicionales (61).
En un estudio sobre los efectos adversos de medicamentos oftálmicos por vía tópica se observó una incidencia del 7’4% de reacciones confirmadas y del 37% de reacciones probables frente a los conservantes de las soluciones para el mantenimiento de las LC (62). En el caso de las lentes de uso prolongado tradicionales, a lo largo de 4 años, el 3% de los pacientes tuvieron reacciones causadas por la solución de limpieza (63). En un estudio realizado en un contexto de asistencia a urgencias, las reacciones por la solución de limpieza constituían el 15% de los problemas vistos en consulta en relación con las lentes y sólo afectaban a portadores de lentes blandas (64). La incidencia absoluta de reacciones tóxicas/de hipersensibilidad relacionadas con la solución resulta ser sumamente difícil de cuantificar y puede aparecer por el empleo concomitante de otras preparaciones tópicas. Resulta evidente que las lentes blandas entrañan un riesgo mucho mayor que las rígidas y que el uso diario es el que supone mayor riesgo de conjunto. Se observa que las lentes desechables han reducido el riesgo asociado de queratopatía tóxica y es probable que la posibilidad de un verdadero recambio diario reduzca aún más este riesgo.
2.3.3 Conjuntivitis papilar por lentes de contacto
Se ha comprobado que tanto la hipersensibilidad retardada (65) como la inmediata (66) a los depósitos de las LC (67) intervienen en la patogenia de la conjuntivitis papilar relacionada con las LC (Figura 4). Es probable que también intervengan factores mecánicos en el proceso etiológico (68).
A partir de estudios de cohortes de 2.433 y 1.954 portadores de LC cosméticas que acudían a consultorios privados (31,32), se ha estimado una prevalencia similar de conjuntivitis papilar con lentes blandas de uso diario y de uso prolongado, y una prevalencia ligera aunque no significativamente menor con lentes desechables en comparación con las lentes reutilizables de uso diario. De la misma forma, un estudio de casos y controles, aunque diseñado para determinar el riesgo de conjuntivitis aguda, no de subaguda, tampoco pudo demostrar que las lentes desechables tuviesen un efecto protector (61). Un pequeño estudio de cohortes realizado en un solo centro mostró una incidencia menor de conjuntivitis papilar por LC entre sujetos portadores de lentes desechables de uso prolongado que entre los usuarios de lentes tradicionales (69). Sin embargo, la conjuntivitis papilar sigue mostrándose como una de las complicaciones más frecuentes de las lentes desechables de uso prolongado, con cifras publicadas del 8% de pacientes (70) y el 2% de los ojos (71) que padecen este trastorno en el primer año de uso de lentes desechables. En un ensayo clínico prospectivo con controles realizado en India se observó una incidencia del 6% (47) con las lentes desechables de hidrogel (Figura 4).
La conjuntivitis papilar gigante se asocia a depósitos en las lentes, uso prolongado, recambio poco frecuente, diámetro grande y limpieza insuficiente
Entre los posibles factores de riesgo asociados con la conjuntivitis papilar se cuentan la exposición a LC cubiertas de depósitos (72), la mayor juventud del paciente (73), los períodos más largos de porte de las lentes, el recambio poco frecuente de las mismas, el uso de lentes más grandes y un régimen de limpieza insuficiente (72). En un estudio retrospectivo de casos y controles se observó un pico estacional de conjuntivitis papilar y una mayor incidencia de alergias en los sujetos con conjuntivitis papilar que en los controles, lo que lleva a pensar en una relación entre la atopia y la conjuntivitis papilar (74). Es probable que parte de las dificultades para interpretar estos datos guarden relación con el uso de las lentes desechables como lentes que resuelven problemas en pacientes predispuestos a tener reacciones de hipersensibilidad. Otra explicación es que la susceptibilidad individual es el factor dominante en esta enfermedad.
2.4. Reacciones metabólicas
Las reacciones metabólicas consisten en edema corneal, necrosis epitelial aguda, microquistes, neovascularización y estrías corneales. Durante el porte de las lentes también durante la noche, las secuelas pueden complicarse por la hipoxia, la acumulación de lactato en el estroma, la alteración del flujo del anhídrido carbónico, los traumatismos mecánicos, la hipertonicidad de la lágrima y la alteración del intercambio de lágrimas y metabolitos bajo la lente.
Varios estudios de casos y controles han mostrado que el uso prolongado es, con mucho, el factor de riesgo más importante en cuanto a las complicaciones metabólicas y las diferencias entre las lentes blandas y rígidas de uso diario no han resultado significativas (1,2,61). En el caso de las complicaciones metabólicas, el uso de las lentes también durante la noche tiene un riesgo relativo de 2’1x (intervalo de confianza del 95%: 1’3-3’4) mayor que el uso de lentes permeables a los gases (2) o de 3’3x (intervalo de confianza del 95%: 1’2-8’7) mayor que el uso de lentes rígidas de polimetil metacrilato (1).
Se ha comprobado en estudios de cohortes que, en comparación con las LC tradicionales, las lentes desechables reducen de forma significativa la incidencia de edema corneal o de microquistes tanto en la modalidad de uso diario como en la de uso prolongado. En estudios de cohortes de 2.433 y 1.954 usuarios de LC cosméticas que acudían a consultorios privados, se estimó una prevalencia de 54’6 por 10.000 entre los usuarios de lentes desechables de uso prolongado frente a 114’7 por 10.000 entre los portadores de LC tradicionales de uso prolongado y de 168’3 por 10.000 entre los usuarios de lentes desechables de uso diario frente a 254’8 por 10.000 entre los portadores de lentes tradicionales de uso diario (31,32). Sin embargo, en un estudio de casos y controles no se han observado diferencias en cuanto al riesgo entre los usuarios de lentes tradicionales y los de lentes desechables (62). Aún así, algunos autores han informado de una alta incidencia de síndrome de la lente cerrada y de epiteliopatía microquística con el uso de lentes desechables de uso prolongado (69,70,75-77).
2.4.1 Estrías corneales
Las estrías corneales se observan cuando el edema corneal es superior al 6% aproximadamente (78). Se ha comprobado una incidencia anual del 1’1% en el primer año de porte de lentes de hidrogel desechables de uso prolongado entre sujetos miopes que utilizaban LC por vez primera (47). En un estudio basado en pacientes que portaban en un ojo una lente desechable de uso diario y en el ojo contralateral una lente desechable de uso prolongado, a lo largo de un año de seguimiento se observaron estrías corneales en el 3% de los ojos que seguían llevando la lente durante la noche y en ninguno de los que portaban lentes de uso diario (71). Además, las lentes positivas de hidrogel de bajo contenido en agua constituyen un factor de riesgo significativo para la aparición de estrías (79).
2.4.2 Neovascularización corneal
Se ha descrito la aparición de neovasos con todos los tipos de LC, pero la mayor frecuencia se asocia con las lentes blandas de uso prolongado (80,81). Se ha señalado al relleno de los capilares límbicos o hiperemia límbica como el precursor de la neovascularización corneal, y se ha demostrado que existe una asociación significativa entre el grado de hiperemia límbica y una menor transmisibilidad al oxígeno por parte de la lente blanda (82). La hiperemia límbica también es mayor en los portadores de lentes blandas que en los que usan lentes rígidas o no utilizan ningún tipo de lente (83).
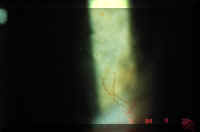
En un estudio prospectivo reciente sobre lentes desechables de hidrogel de uso prolongado en una población sin experiencia (n = 330), la incidencia anual de neovascularización fue del 1’5% (47) (Figura 5).
2.4.3 Microquistes corneales
Los microquistes son pequeñas inclusiones epiteliales (Figura 6) que se consideraban una reacción retardada a altos niveles de hipoxia corneal (84).

Se observan microquistes tanto en sujetos que no utilizan LC, como con todos los tipos de lentes (84). Se calcula una incidencia del 28% en los no portadores de lentes y del 34% en los que utilizan lentes blandas de uso diario, pero el número de microquistes en estos grupos es escaso (84). Se ha observado un alto número de microquistes (< 50) dispersos por la córnea en sujetos que llevaban varios meses utilizando lentes blandas de uso prolongado (48) y la cifra aumenta con la frecuencia del uso durante la noche (84). En un estudio de 12 meses en el que se comparó el uso prolongado de lentes blandas y de lentes rígidas en una población de sujetos que utilizaban LC, pero no de forma habitual, se observaron microquistes hasta en el 50% de los sujetos que utilizaron lentes blandas de uso prolongado, frente al 35% de los portadores de lentes de uso prolongado permeables al gas (85). A igualdad de transmisibilidad para el oxígeno, las LC blandas ocasionan la aparición de más microquistes que las lentes permeables al gas (84).
Las lentes desechables se han asociado tanto con una mayor frecuencia de microquistes (69,75,76) como con una frecuencia similar (84). Sin embargo, Poggio demostró que la prevalencia de microquistes y de edema corneal era menor con las lentes desechables que con las de uso tradicional, tanto en las pautas de uso diario como en las de uso prolongado (31,32). Esta observación puede deberse al hecho de haber agrupado estos trastornos para su análisis.
2.5 Complicaciones mecánicas
La interacción entre la lente de contacto y la córnea puede causar erosiones corneales, abrasiones y lesiones arciformes del epitelio corneal superior. Las LC blandas, tanto en régimen de uso diario como prolongado, entrañan un menor riesgo de reacciones asociadas a traumatismos que las LC rígidas (1,2). En comparación con las lentes rígidas permeables a los gases, se ha observado que el riesgo relativo de las lentes blandas de uso diario era menor en 0’3x (intervalo de confianza del 95%: 0’2-0’6) y el de las lentes blandas de uso prolongado era menor en 0’2x (intervalo de confianza del 95%: 0’1-0’4) (2).
Las complicaciones mecánicas son más frecuentes en usuarios de lentes rígidas permeables que en usuarios de lentes blandas.
Es probable que la sustitución frecuente de las LC minimice el riesgo de complicaciones mecánicas debidas a cambios en los parámetros de las lentes con la edad o a la acumulación de depósitos sobre la superficie de las mismas. Dentro del grupo de portadores de LC blandas, se ha observado una frecuencia significativamente menor de reacciones mecánicas con las lentes desechables (31,32). Se ha informado de una prevalencia de 7’0 por 10.000 en el caso de las lentes desechables de uso diario y de 40’6 por 10.000 en el caso de las lentes tradicionales de uso diario (31,32).
2.5.1 Lesiones arciformes del epitelio corneal superior
Las lesiones arciformes del epitelio corneal superior pueden asociarse con la presión mecánica ejercida por el párpado y la lente de contacto sobre la córnea, con una posible contribución de la hipoxia (Figura 7). Las lesiones arciformes son fundamentalmente una complicación del uso de lentes blandas y no se han relacionado con las lentes rígidas. Según estudios, la cifra alcanza al 5% de la población de portadores de lentes blandas (86). En fecha más reciente, se ha estimado una incidencia anual del 1’5% en portadores de lentes de hidrogel desechables de uso prolongado (47). Se ha comprobado que el sexo masculino, la antigüedad de la lente y las lentes cuyo centro tiene el mismo espesor que el borde son factores potenciales de riesgo de lesión arciforme (86).
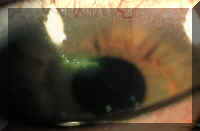
2.5.2 Erosiones/abrasiones corneales
En un estudio retrospectivo a gran escala sobre los pacientes de 7 clínicas privadas (n = 66.218) se observó una prevalencia mayor de erosiones corneales entre los portadores de lentes rígidas de PMMA (1’0%) y lentes blandas de uso diario (0’5%) que entre los que utilizaban lentes permeables a los gases (0’2%) (87). Según un estudio más reciente (n = 23.068), la prevalencia de erosiones corneales era del 1% en usuarios de lentes rígidas y rígidas permeables a los gases, del 0’6% en los portadores de lentes blandas de HEMA de uso diario, del 0’4% en los portadores de LC de alto contenido en agua y uso diario, del 0’1% en los usuarios de lentes desechables de uso prolongado y del 0% en los que utilizaban lentes desechables de uso diario (88).

Un estudio realizado en un contexto de urgencias sobre complicaciones agudas relacionadas con las LC mostró que el 17% de dichas complicaciones podían atribuirse a abrasiones en portadores de lentes rígidas y permeables a los gases (Figura 8), mientras que sólo el 3% y el 7% podían atribuirse a lentes blandas de uso diario y uso prolongado, respectivamente (80).
2.6 Molestias y sequedad
Se conocen mal las molestias asociadas al uso de LC. Los síntomas van desde una ligera incomodidad hasta intensos dolores que pueden conducir a que el paciente no tolere las lentes. Las molestias son el motivo más frecuente por el que se interrumpe su uso (89,90) y representan el 30% de dichas interrupciones. Los portadores de LC refieren más síntomas de molestias oculares que las personas que usan gafas; sin embargo, la frecuencia de las molestias fue, sorprendentemente, la misma entre los portadores de lentes blandas y los de lentes rígidas (91). Los factores de riesgo de padecer molestias relacionadas con las LC son difíciles de determinar con precisión, si bien los sujetos con rinoconjuntivitis alérgica (89), los varones jóvenes (89,90) y los sujetos ancianos (90) refieren con más frecuencia molestias o intolerancia a las LC. Factores ambientales tales como una baja humedad relativa, un tiempo corto de rotura de la película lagrimal, aumento de los depósitos en la lente y la escasa movilidad de ésta se asocian con quejas de molestias por sequedad (92).
Las molestias oculares son el principal motivo de abandono del uso de lentes de contacto y aparecen con más frecuencia en: varones jóvenes, sujetos alérgicos, tiempo corto de rotura de la película lagrimal, depósitos en las lentes y escasa movilidad de las mismas.
Con la comercialización de las lentes desechables se esperaba que el confort subjetivo mejorase. Los estudios sobre el uso de estas lentes mostraron una menor frecuencia de síntomas en comparación con las lentes tradicionales de uso prolongado (69) y las lentes de uso diario tradicionales y de recambio frecuente (34,35). La prevalencia de las molestias o de los síntomas de sequedad sigue siendo del 30% (70). Las lentes desechables han mejorado un poco los problemas de molestias relacionadas con las LC, pero no los han resuelto.

3. CONCLUSIONES
Las LC tienen ventajas evidentes desde el punto de vista óptico, laboral, deportivo y cosmético para millones de usuarios, si bien su uso se ha asociado con ciertos riesgos. Tanto en el caso de las complicaciones frecuentes relacionadas con las LC, como en el de las infrecuentes, se ha comprobado que hay diferencias en cuanto al riesgo que entrañan los diversos tipos de lentes y de regímenes de uso. Dada la gran población actual de portadores de LC a nivel mundial, incluso las reacciones poco frecuentes pueden afectar a un elevado número de ellos. Esto se convierte en un problema para la prestación de la asistencia primaria oftalmológica y para los profesionales que adaptan LC y tratan las enfermedades relacionadas con su uso.
Es fundamental que oftalmólogos y ópticos conozcan la epidemiología de los trastornos relacionados con el uso de las LC, en particular el aumento del riesgo de todas las complicaciones, excepto los trastornos mecánicos, con el porte prolongado, para poder realizar una elección documentada de la modalidad de lente, del régimen de uso y de las medidas de higiene. Los datos epidemiológicos también proporcionan información sobre las causas de las complicaciones relacionadas con las LC, la cual es necesaria para desarrollar modalidades de porte más seguras.

Bibliografía
1. Franks WA, Adams GCW, Dart JKG, et al. Relative risks of different types of contact lenses. Br Med J 1988;297:525.
2. Stapleton F, Dart JKG, Minassian D. Nonulcerative complications of contact lens wear: relative risk for different lens types. Arch Ophthalmol 1992;110:1601-1606.
3. Golden B, Fingerman LH, Allen HF. Pseudomonas corneal ulcers in contact lens wearers. Arch Ophthalmol 1971;85:543-547.
4. Cooper RL, Constable IJ. Infective keratitis in soft contact lens wearers. Br J Ophthalmol 1977;61:250-254.
5. Galentine PG, Cohen EJ, Laibson PR, et al. Corneal ulcers associated with contact lens wear. Arch Ophthalmol 1984;106:891-894.
6. Alfonso E, Mandelbaum S, Fox MJ, et al. Ulcerative keratitis associated with contact lens wear. Am J Ophthalmol 1986;101:429-433.
7. Dart JKG. Predisposing factors in microbial keratitis. The significance of contact lens wear. Br J Ophthalmol 1988;72:926-930.
8. Koidou-Tsigliani A, Alfonso E, Forster RK. Ulcerative keratitis associated with contact lens wear. Am J Ophthalmol 1989;108:64-67.
9. Dart JKG, Stapleton F, Minassian D. Contact lenses and other risk factors in microbial keratitis. Lancet 1991;338:650-653.
10. Poggio EC, Glynn RJ, Schein OD, et al. The incidence of ulcerative keratitis among users of daily-wear and extended-wear soft contact lenses. N Eng J Med 1989;321:779-783.
11. Nilsson SEG, Montan PG. The annualized incidence of contact lens induced keratitis in Sweden and its relation to lens type and wear schedule: results of a 3-month prospective study. CLAO J 1994;20:225-230.
12. Nilsson SEG, Montan PG. The hospitalized cases of contact lens induced keratitis in Sweden and their relation to lens type and wear schedule: results of a three-year retrospective study. CLAO J 1994;20:97-101.
13. Cheng KH, Luang SL, Hoekman JW, et al. Incidence of contact lens associated ulcerative keratitis and its related morbidity. Invest Ophthalmol Vis Sci (Suppl ARVO) 1998;39:1563.
14. McRae S, Herman C, Stulting RD, et al.Corneal ulcers and adverse reaction rates in premarket contact lens studies. Am J Ophthalmol 1991;111:457-465.
15. Weissman BA, Remba MJ, Fugedy E. Results of the extended wear Contact Lens Section of the American Optometric Association. J Am Optom Assoc 1987;58:166-171.
16. Schein OD, Glynn RJ, Poggio EC, et al. The relative risk of ulcerative keratitis among users of daily-wear and extended-wear soft contact lenses. N Eng J Med 1989:321:773-778.
17. Wilson LA, Schlitzer RL, Ahearn DG. Pseudomonas corneal ulcers associated with soft contact lens wear. Am J Ophthalmol 1981;92:546-554.
18. Mondino BJ, Weissman BA, Farb MD, et al. Corneal ulcers associated with daily-wear and extended-wear soft contact lenses. Am J Ophthalmol 1986;102:58-65.
19. Stapleton F, Dart JKG, Seal DV, et al. Epidemiology of Pseudomonas aeruginosa keratitis in contact lens wearers. Epidemiol Infect 1995;114:395-402.
20. Mayo DS, Schlitzer RL, Ward MA, et al. Association of Pseudomonas and Serratia corneal ulcers with the use of contaminated solution. J Clin Microbiol 1987;25:1398-1400.
21. Donzis PB, Mondino BJ, Weissman BA, et al. Microbial contamination of contact lens care systems. Am J Ophthalmol 1987;104:325-333.
22. Larkin DFP, Kilvington S, Easty DL. Contamination of contact lens storage cases by Acanthamoeba and bacteria. Br J Ophthalmol 1990;74:133-135.
23. Devonshire P, Munro FA, Abernathy C, et al. Microbial contamination of contact lens care systems. Br J Ophthalmol 1993;77:41-45.
24. Gray TB, Cursons JT, Sherwan JF, et al. Acanthamoeba, bacterial and fungal contamination of contact lens storage cases. Br J Ophthalmol 1995;79:601-605.
25. McLaughlin-Borlace L, Stapleton F, Matheson M, et al. Bacterial biofilm on contact lenses and lens storage cases in wearers with microbial keratitis. J Appl Microbiol 1998;84: 827-838.
26. Lakkis C, Harding AS, Brennan NA. Hydrogel lens case contamination. Invest Ophthalmol Vis Sci (Suppl ARVO) 1995;36:1461.
27. Matthews TD, Frazer DG, Minassian DC, et al. Risks of keratitis and patterns of use with disposable contact lenses. Arch Ophthalmol 1992;110:1559-1562.
28. Buehler PO, Schein OD, Stamler, JF, et al. The increased risk of ulcerative keratitis among disposable soft contact lens users. Arch Ophthalmol 1992;110:1555-1558.
29. Schein OD, Buehler PO, Stamler JF, et al. The impact of overnight wear on the risk of contact lens-associated ulerative keratitis. Arch Ophthalmol 1994;112:186-190.
30. Radford CF, Minassian DC, Dart JKG. Disposable contact lens use as a risk factor for microbial keratitis. Br J Ophthalmol (en prensa).
31. Poggio EC, Abelson MB. Complications and symptoms in disposable extended wear lenses compared with conventional soft daily wear and soft extended wear lenses. CLAO J 1993;19:31-39.
32. Poggio EC, Abelson MB. Complications and symptoms with disposable daily wear contact lenses and conventional soft daily wear contact lenses. CLAO J 1993;19:95-102.
33. Nason RJ, Boshnick EL Cannon WM. Multisite comparison of contact lens modalities. Daily disposable wear vs. Conventional daily wear in successful contact lens wearers. J Am Optom Assoc 1994;65:774-780.
34. Solomon OD, Freeman MI, Boshnick EL, et al. A 3-year prospective study of the clinical performance of daily disposable contact lenses compared with frequent replacement and conventional daily wear contact lenses. CLAO J 1996;22:250-257.
35. Nilsson SEG, Soderqvist M. Clinical performance of a daily disposable contact lens. A three month prospective study- J Br Contact Lens Assoc 1995;18:81-86.
36. Hingorani M, Christie C, Buckley RJ, et al. Ulcerative keratitis in a person wearing daily disposable contact lenses. Br J Ophthalmol 1995;79:1138.
37. Auran JD, Starr MB, Jakobiec FA. Acanthamoeba keratitis: a review of the literature. Cornea 1987;6:2-26.
38. Sharma S, Srinivasan M, George C. Acanthamoeba keratitis in non-contact lens wearers. Arch Ophthalmol 1990;108:676-678.
39. Stehr-Green JK, Bailey TM, Visvesvara GS. The epidemiology of Acanthamoeba keratitis in the United States. Am J Ophthalmol 1989; 107:331-336.
40. Stehr-Green JK, Bailey TM, Brabdt FH, et al. Acathamoeba keratitis in soft contact lens wearers. J Am Med Assoc 1987;258:57-60.
41. Stein RM, Clinch TE, Cohen EJ, et al. Infected vs. sterile corneal infiltrates in contact lens wearers. Am J Ophthalmol 1988;105: 632-636.
42. Stapleton F, Dart JKG, Minassian D. Risk factors with contact lens related suppurative keratitis. CLAO J 1993;19:204-210.
43. Josephson JE, Caffery BE. Infiltrative keratitis in hydrogel lens wearers. Int Contact Lens Clin 1979;6:47-70.
44. Bates AK, Morris RJ, Stapleton F, et al. "Sterile" corneal infiltrates in contact lens wearers. Eye 1989;3:803-810.
45. Cutter GR, Chalmers RL, Roseman M. The clinical presentation, prevalence, and risk factors of focal corneal infiltrates in soft contact lens wearers. CLAO J 1996;22:30-37.
46. Vajdic CM, Holden BA, Sweeney DF, et al. Do contact lens wearers have more ocular discomfort than spectacle lens wearers? Invest Ophthalmol Vis Sci (Suppl ARVO) 1996;37:1129.
47. Sankaridurg PR, Sweeney DF, Sharma S, et al. Adverse events with extended wear of disposable hydrogels: results for the first thirteen months of lens wear. En preparación.
48. Zantos SG. Management of corneal infiltrates in extended-wear contact lens patients. Int Contact Lens Clin 1984;11:604-610.
49. Swarbrick HA, Holden BA. Complications of hydrogel extended wear lenses. En: Anterior segment complications of contact lens wear (Ed: JA Silbert). Churchill Livingstone, New York 1994; pp 289-316.
50. Sankaridurg PR, Willcox MDP, Sharma S, et al. Haemophilus influenza adherent to contact lenses associated with production of acute ocular inflammation. J Clin Microbiol 1996;34:2426-2431.
51. Holden BA, LaHood D, Grant T, et al. Gram-negative bacteria can induce contact lens related acute red eye (CLARE) responses. CLAO J 1996;22:47-52.
52. Holden BA, Reddy MK, Sankaridurg PR, et al. The histopathology on contact lens induced peripheral corneal ulcer. Invest Ophthalmol Vis Sci (Suppl ARVO) 1997;38:201.
53. Willcox MDP, Sweeney DF, Sharma S, et al. Contact lens peripheral ulcers are associated with increased bacterial contamination of contact lenses. Invest Opthalmol Vis Sci 1995 (Suppl ARVO) 1995;36:152.
54. Jalbert I, Willcox MDP, Sweeney DF. Contact lens induced peripheral ulcer associated with Staphylococcus aureus: case report. Optom Vis Sci 1997 (Suppl) 74:186.
55. Mondino BJ, Salamon SM, Zaidman GW. Allergic and toxic reactions in soft contact lens wearers. Surv Ophthalmol 1982;26:337-344.
56. Coward BD, Neumann R, Callender M. Solution intolerance among users of four chemical soft lens care regimens. Am J Optom Physiol Opt 1984;61:523-527.
57. Fonn D. Adverse responses to a chlorhexidine tablet disinfectiob system. Invest Ophthalmol Vis Sci (Suppl ARVO) 1991;32:738.
58. Morgan J. Complications associated with contact lens solutions. Ophthalmology 1979;86: 1107-1119.
59. Simmons PA, Clough SR, Teagel RH, et al. Toxic effects of ophthalmic preservatives on cultured rabbit corneal epithelium. Am J Optom Physiol Opt 1988;65:867-873.
60. Davies RL. Animal vs. plant enzyme. Int Contact Lens Clin 1983;10:277-285.
61. Radford CF. The epidemiology of contact lens related disease in users of disposable lenses. PhD Thesis 1993. City University, London.
62. Wilson FM. Adverse external ocular effects of topical ophthalmic therapy: an epidemiologic, laboratory and clinical study. Trans Am Ophthalmol Soc 1983;81:854-965.
63. Lamer L. Extended wear contact lenses for myopes: a follow-up study of 400 cases. Ophthalmology 1983;90:156-161.
64. Genvert GI, Cohen EJ, Parlato CJ, et al. A prospective study of emergency room visits for contact lens related problems. CLAO J 1987;13:42-45.
65. Allansmith MR, Korb DR, Greiner JV, et al. Giant papillary conjunctivitis in contact lens wearers. Am J Ophthalmol 1977;83:697-708.
66. Donshik PC, Ballow M. Tear immunoglobulins in giant papillary conjunctivitis induced by contact lenses. Am J Ophthalmol 1983;96: 460-466.
67. Ballow M, Donshik PC, Rapacz P, et al. Immune response in monkeys to lenses from patients with contact lens induced giant papillary conjunctivitis. CLAO J 1989;15:64-70.
68. Greiner JV. Papillary conjunctivitis induced by an epithelialised corneal foreign body. Ophthalmologica 1988;196:82-86.
69. Boswall GJ, Ehlers WH, Luistro A, et al. A comparison of conventional and disposable extended wear contact lenses. CLAO J 1993;19:158-165.
70. Maguen E, Tsai JC, Martinez M, et al. A retrospective study of disposable extended-wear lenses in 100 patients. Ophthalmology 1991; 98:1685-1689.
71. Levy B, McNamara N, Corzine J, et al. Prospective trial of daily and extended wear disposable contact lenses. Cornea 1997;16:274-276.
72. Allansmith MR. Giant papillary conjunctivitis. J Am Optom Assoc 1990 (Suppl);61:42-46.
73. Hart DE, Schkolnick JA, Berntein S, et al. Contact lens induced giant papillary conjunctivitis: a retrsopective study. J Am Optom Assoc 1989;60:195-204.
74. Begley CG, Riggle A, Tuel JA. Association of giant papillary conjunctivitis with seasonal allergies. Optom Vis Sci 1990;67:192-195.
75. Epstein AB, Donnenfield ED. Epithelial microcysts associated with the Acuvue disposable CL. Contact Lens Forum 1989;March:35-36.
76. Josephson JE, Caffery BE, Campbell I, et al. Disposable contact lenses vs. contact lens maintenance for extended wear. CLAO J 1990;16:184-188.
77. Netland PA. Tight lens syndrome with extended wear contact lenses. CLAO J 1990;16:308-310.
78. Polse KA, Mandell RR. Etiology of corneal striae accompanying hydrogel. Invest Ophthalmol 1976;15:553-556.
79. LaHood D. Daytime edema levels with plus powered low and high water content hydrogel contact lenses. Optom Vis Sci 1991; 68:877-880.
80. Barry PJ, Ruben M. Contact lens injuries – An analysis of 217 consecutive patients presenting to Moorfields Casualty Department. Contact Lens J 1980;9:6-10.
81. Cunha MC, Thomassen TS, Cohen EJ, et al. Complications associated with soft contact lens use. CLAO J 1987;13:107-111.
82. Papas EB, Vajdic CM, Auster R, et al. High oxygen transmissibility soft contact lenses do not induce limbal hyperemia. Curr Eye Res 1997;16:942-948.
83. McMonnies CW, Chapman-Davies A, Holden BA. The vascular response to contact lens wear. Am J Optom Physiol Opt 1982;59:795-799.
84. Holden BA, Sweeney DF. The significance of the microcyst response: a review. Optom Vis Sci 1991;68:703-707.
85. Young G, Port M. Rigid gas-permeable extended wear: a comparative clinical study. Optom Vis Sci 1992;69:214-226.
86. Hine N, Back A, Holden BA. Aetiology of arcuate epithelial lesions induced by hydrogels. Trans BCLA Conference 1987;48-50.
87. Hamano H, Kitano J, Mitsunaga S, et al. Adverse effects of contact lens wear in a large japanese population. CLAO J 1985;11:141-147.
88. Hamano H, Watanabe K, HamanoT, et al. A study of the complications induced by conventional and disposable contact lenses. CLAO J 1994;20:103-107.
89. Kumar P, Elston R, Black D, et al. Allergic rhinoconjunctivitis and contact lens intolerance. CLAO J 1991;17:31-34.
90. Weed KH, Fonn D, Potvin R. Discontinuation of contact lens wear. Optom Vis Sci 1993 (Suppl);70:140.
91. Vajdic CM, Sweeney DF, Cornish R, et al. The incidence of idiopathic corneal infiltrates with disposable and rigid gas permeable daily and extended wear. Invest Ophthalmol Vis Sci (Suppl ARVO) 1995;36:151.
92. Nilsson SEG, Andersson L. Contact lens wear in dry environments. Acta Ophthalmol 1986; 16:308-310.
93. Efron N, Wohl A, Toma NG, et al. Pseudomonas corneal ulcers associated with daily wear of disposable hydrogel contact lenses. Int Contact Lens Clin 1991;18:46-51.
94. Chalupa, E, Swarbrick HA, Holden BA, et al. Severe corneal infections associated with contact lens wear. Ophthalmology 1987;94: 17-22.




 3. CONCLUSIONES
3. CONCLUSIONES.jpg)
.jpg)
